北京时间11月7日,《science advances》在线刊登了我校生命科学与技术学院、北京市生物加工过程重点实验室罗施中教授的最新研究成果“low-complexity domain of u1-70k modulates phase separation and aggregation through distinctive basic-acidic motifs”。该文揭示了一种与阿尔兹海默症相关的新发现蛋白u1-70k的相分离机理及其与聚集过程的关系,加深了人们对于阿尔兹海默症的致病机理与相分离现象的理解。

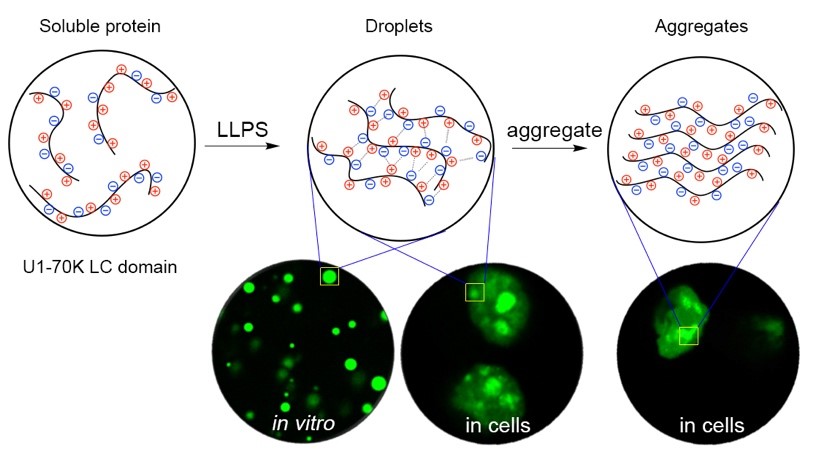
阿尔兹海默症是常见的神经退行性疾病,传统的观点认为其致病机理与名为abeta和tau的蛋白聚集有关。而近来一种名为u1-70k的蛋白质在病人脑组织中被发现,成为研究该疾病研究的潜在新靶点。相分离是一种溶液中溶质自发形成高浓度和低浓度相的现象,被认为是细胞内多种无膜细胞器的形成过程,并与蛋白聚集密切相关,已成为相关疾病研究的热点。本文通过对u1-70k及其低复杂度片段的相分离现象与调控因素的研究,揭示了正负电荷交替的氨基酸序列驱动相分离的机理,以及不同序列对于功能性相分离与病理性聚集选择的倾向性。另外,文中首次观测到了在细胞内u1-70k由相分离向聚集体转化的过程,揭示了其可能的致病途径。该发现不仅为阿尔兹海默症的相关研究开辟了新思路,也为此类富含电荷蛋白的性质与功能研究提供了新的方向。
北京化工大学生命科学与技术学院罗施中教授为本文的通讯作者,薛松副教授、硕士生龚瑞和何凡奇为共同第一作者,感谢谭天伟院士对本工作的指导和帮助,北京化工大学为论文独立完成单位。本研究工作得到国家自然科学基金委、国家重点研发计划及北京化工大学中央高校基本科研业务费的大力资助。
文章链接https://advances.sciencemag.org/content/5/11/eaax5349 (doi: 10.1126/sciadv.aax5349)
