胰腺癌是一种高度致命的恶性肿瘤,经过数十年的努力,其五年生存率仍低于10%。目前胰腺癌化疗面临的挑战包括:(i)肿瘤生物屏障阻碍药物穿透和细胞内化,递送效率低;(ii)药物失活降低化疗效率,并产生耐药性。研究指出,肿瘤内存在的共生细菌介导了化疗药物的失活(science 2017, 357, 1156):细菌酶将药物代谢成非活性形式,最终导致耐药性。深入研究表明,大多数胰腺癌患者的肿瘤中存在共生细菌,且主要是胞内菌(science 2020, 368, 973)。因此,亟需开发一种新策略,既能增加药物的渗透,又能优先清除肿瘤中的细菌(胞外菌和胞内菌),以提升胰腺癌的治疗效果。
北京化工大学生命科学与技术学院王兴教授课题组前期围绕药物递送和胞内菌清除开展了系列研究工作:发展了一种可控合成手性氨基酸侧链聚合物的新方法(polym. chem. 2018, 9, 2733. cover);研究了一系列聚氨基酸组装结构并构建酸响应性长效药物递送系统(dds: biomacromolecules 2021, 22, 4871; colloids surf. b 2021, 202, 111687);进而利用d构型氨基酸用以构建细菌壁的生命本征,创建了级联靶向纳米dds,实现胞内菌精准靶向清除(adv. mater. 2022, 2109789);此外,设计构建了感染微环境响应降解联合光热治疗纳米dds,消除皮下多药耐药菌感染(adv. sci. 2022, 9, 2200732);上述研究工作为胰腺癌瘤内菌联合治疗铺垫了实验基础。
针对胰腺癌瘤内菌联合治疗,课题组设计并构建了一种具有“攻防机动”的双级联响应纳米粒子(snp@g/ir),优先清除肿瘤中的胞内菌并实现精准药物递送。作者首先精准合成胍基修饰的两亲性抗菌聚合物(sgp),用于替代抗生素以避免耐药。通过调节侧链胍基的修饰数量,筛选得到具有最佳杀菌活性和选择性的聚合物sgp2(phmg单元数:n = 7,选择性指数:hc10/mic = 20),实现了杀菌能力与细胞毒性的平衡。进而以sgp2为载体,负载胰腺癌治疗药物吉西他滨(gem)和红外二区光热染料(ir1048),形成核心纳米粒子(np@g/ir)。外层采用酶响应性透明质酸(ha)包覆,获得具有核壳结构的纳米粒子(snp@g/ir)。通过这种巧妙的组装:(i)snp@g/ir利用ha壳靶向cd44积累在肿瘤部位,随后被胞外基质(ecm)中的透明质酸酶(haase)降解,脱除壳层;(ii)释放的np@g/ir尺寸减小且电荷反转,从而促进深层肿瘤穿透,在此过程中,np@g/ir的胍基通过破坏细菌膜能够杀死遇到的瘤内胞外菌;(iii)带正电的np@g/ir进入肿瘤细胞杀死胞内菌;此外,细胞内gsh触发二硫键断裂,从而释放gem和ir1048,gem可以最大限度地免受细菌代谢并成功杀死胰腺癌细胞,联合ir1048的局部光热治疗,可以提高抗癌和细菌消除效果;此后,(iv)这种治疗还能够促进细胞毒性t细胞的产生,调节肿瘤的先天免疫反应,进一步增强抗癌作用。由此,肿瘤内的细菌被优先消灭,gem得到保护,后续响应释放,完成所设计的“攻防机动”及联合治疗。因此,智能snp@g/ir可以大幅提高胰腺癌的治疗效果。
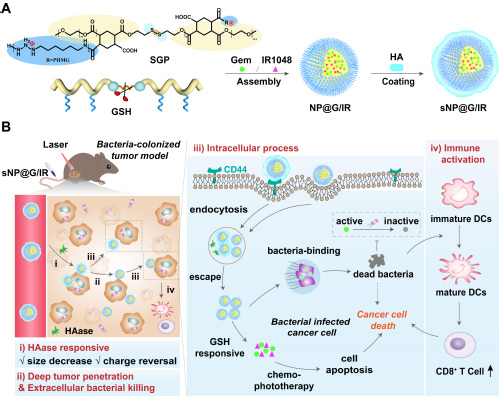
图1.级联响应snp@g/ir清除瘤内菌增强胰腺癌治疗效果
文章要点:
(1)级联响应性snp@g/ir的结构与基础性能。研究表明,核壳结构的snp@g/ir具有haase和gsh的级联响应性(图2)。在haase作用下,snp@g/ir的ha外壳被降解,释放np@g/ir,实现粒径减小和电荷反转。在10 mm gsh环境中,np@g/ir会快速瓦解,释放gem,在48 h内释放效率高达93.7%。此外,在1064 nm激光照射下,snp@g/ir具有优异的光热性能。
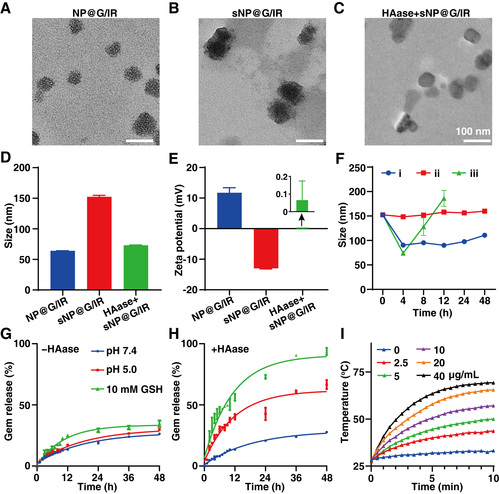
图2. snp@g/ir的表征
(2)snp@ir的体外杀菌活性。研究表明,胍基赋予snp@ir良好的杀菌活性,在激光照射下,ir1048引发的光热效应为彻底根除细菌提供了有效助力(图3)。共聚焦图像显示,np@rhb与细菌的荧光高度重合,说明由于阳离子胍基的存在,np可以快速与细菌结合。进一步disc35探针和细菌sem的成像表明,np通过诱导细菌细胞膜去极化,破坏细菌细胞膜而发挥杀菌活性。
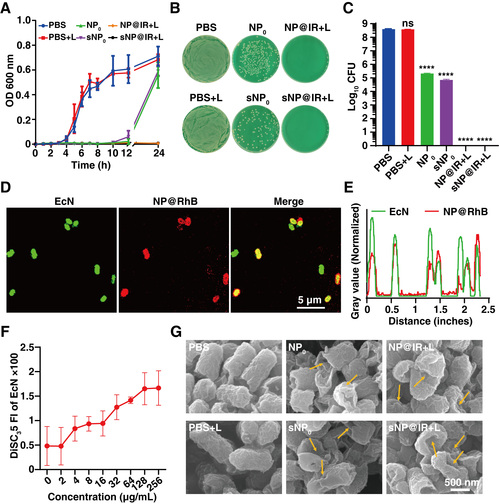
图3. snp@ir的体外抗菌活性
(3)snp@g/ir的胞内行为及清除胞内菌。研究表明,snp@g/ir通过cd44受体介导细胞內吞(图4)。在溶酶体的haase作用下,np@g/ir被释放;由于表面胍基的存在,np@g/ir可以快速地从溶酶体逃逸。snp@g/ir通过gem和光热的联合治疗,诱导癌细胞凋亡,从而杀死癌细胞。基于体外构建的癌细胞胞内菌模型,探究snp@ir对胞内菌的清除能力,由于出色的膜穿透能力和有效的杀菌活性,无光热治疗的snp0和np0组的胞内菌均受到显著抑制(减少5-log10 cfu);经激光照射后,np@ir和snp@ir组的胞内菌被完全清除(相对进一步减少4-log10 cfu)。
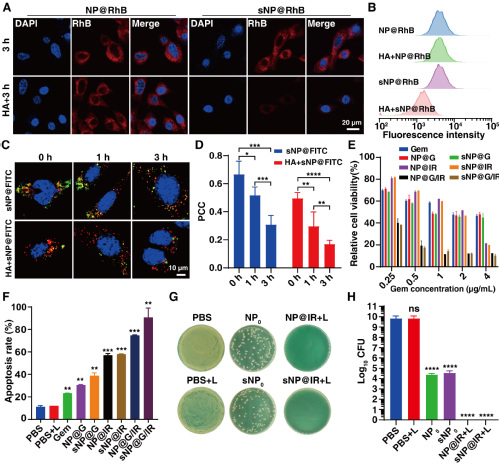
图4. snp@g/ir的胞内行为以及对胞内菌的清除
(4)体内抗菌及抗癌活性。作者构建了细菌感染的皮下胰腺癌肿瘤模型。通过分离肿瘤组织和肿瘤细胞,发现构建的肿瘤模型中存在大量的胞内菌。经治疗后,snp@g/ir l(3.9 log10 cfu, ****, p = 0.00005)具有最优的瘤内菌清除效果,显著低于对照组snp@g (6.3 log10 cfu, **, p = 0.004), snp@ir l (5.9 log10 cfu, *, p = 0.02) 和np@g/ir l (5.2 log10 cfu, *, p = 0.01)(图5)。在第14天时,snp@g治疗组的相对肿瘤体积v/v0约为2.05,在仅ptt发挥抗癌作用的snp@ir l组中,v/v0为2.27,表明化疗和ptt的治疗效果相当;没有ha靶向壳的np@g/ir l治疗组(v/v0 = 1.20, ****, p = 0.00001)体现了联合治疗的优势,而具有ha靶向壳的snp@g/ir l治疗组对细菌感染肿瘤的抑制能力最强(v/v0 = 0.43, ****, p = 0.00002)。snp@g/ir克服了细菌介导的gem失活,联合光热治疗后,体现出最强的肿瘤抑制效果,并将小鼠的存活期延长至60天以上。
图5.细菌感染的肿瘤模型中的体内抗菌及抗癌活性
综上所述,本论文提出了一种双级联响应的纳米粒子snp@g/ir用于胰腺癌瘤内菌的联合治疗。这种snp@g/ir是一个新的非抗生素治疗案例,通过精确调节胍基单位显示出最佳的杀菌活性和选择性。双级联响应的设计赋予snp@g/ir多种功能优势,包括主动肿瘤靶向、深度肿瘤穿透、增加细胞内化和控制药物释放。通过消除瘤内菌(胞外菌和胞内菌)并提高药物递送效率,snp@g/ir克服了细菌介导的gem失活,极大地抑制了细菌感染的肿瘤以及激活了肿瘤免疫,从而提供了一种创新的“攻防机动”联合治疗新策略。
相关研究成果近期以“dual-cascade responsive nanoparticles enhance pancreatic cancer therapy by eliminating tumor-resident intracellular bacteria”为标题发表在学术期刊advanced materials(if = 32.086)上。本论文第一作者为北京化工大学生命科学与技术学院博士研究生康晓旭。北京化工大学王兴教授为论文的唯一通讯作者,北京化工大学李国锋副教授、喻盈捷副教授、中日友好医院刘芳副主任医师、中科院化学所肖海华研究员参与了本研究工作。该研究得到国家自然科学基金、国家创新药物重大专项、中央高校基础研究基金和北京市自然科学基金的资助与支持。
论文链接:
https://onlinelibrary.wiley.com/doi/epdf/10.1002/adma.202206765
