叶绿体起源于蓝藻细胞内共生,是植物特有的光合细胞器,其由双层膜包裹,至今仍像一个独立个体一样进行二分裂[1]。在叶绿体分裂期间,在分裂位点形成蛋白质复合物,与微管蛋白相关的ftsz充当分裂位点复合物的支架蛋白。ftsz蛋白组装形成多聚体,在分裂位点形成环状结构,ftsz环的形成由min系统调节,以确保在叶绿体的中心仅形成一个ftsz环。在叶绿体中,ftsz通过ftsz2的c端结构域和arc6的n端结构域相互作用锚定在内膜上,而arc6的c末端结构域与外膜蛋白pdv2的c末端相互作用。植物min系统还有多种调节蛋白,包括mcd1、arc3及parc6。parc6,也称为cdp1,作为arc6蛋白的同源蛋白,但其在叶绿体分裂过程中的功能与arc6存在明显差异,parc6的n-末端结构域定位于叶绿体的基质侧,与arc3相互作用并促进其功能,而arc6会将pdv2募集到叶绿体分裂位点,并且 pdv2也会影响叶绿体分裂蛋白复合物的组装。2017年3月,我校冯越教授课题组与北京林业大学高宏波教授课题组合作曾在《nature plants》发文报道arc6与pdv2的结构及其调控叶绿体分裂的分子机制[2]。
时隔六年后的2023年1月,我校冯越教授课题组再次与北京林业大学高宏波教授课题组合作在pnas发表题为structural and functional insights into the chloroplast division site regulators parc6 and pdv1 in the intermembrane space的研究论文,揭示了pdv1-parc6相互作用的多层调控机制,完善了对叶绿体分裂过程的了解。
先前的研究认为pdv1与pdv2合作从而将arc5招募到叶绿体分裂位点,pdv1的过度表达不会抑制叶绿体分裂,但会略微促进叶绿体分裂,同时pdv1和arc5之间的相互作用支持了pdv1协助招募arc5到分裂位点的观点。然而,gfp-arc5在后续被证明可以定位于具有严重的叶绿体分裂缺陷的pdv1突变体中,这表明pdv1除了将arc5招募到叶绿体分裂位点之外,还可能发挥其他作用。高宏波教授课题组通过体内实验验证了pdv1蛋白与parc6蛋白之间存在相互作用。冯越教授课题组结合生物化学、结构生物学等多种手段,揭示了parc6–pdv1复合物在膜间隙以及叶绿体分裂中的多层调控作用。首先,冯越课题组解析了parc6蛋白及其结合pdv1的复合物的结构。parc6的低聚状态是由氧化还原条件调节的:在氧化条件下,parc6由于分子内二硫键的存在,其以二聚体形式存在,且螺旋状盖子抑制parc6与pdv1的相互作用;在还原条件下,二硫键的打开导致parc6结合口袋被打开,从而允许pdv1插入parc6的结合口袋中。但有趣的是,在还原状态下,当parc6与pdv1相互作用时,pdv1会促进parc6二聚体的形成。pdv1-parc6复合物的状态除受氧化还原条件调节以外,镁离子浓度也会影响parc6二聚体的稳定性,而这两种条件都受光调节,高宏波教授课题组通过体内实验验证了上述结论(图1)。
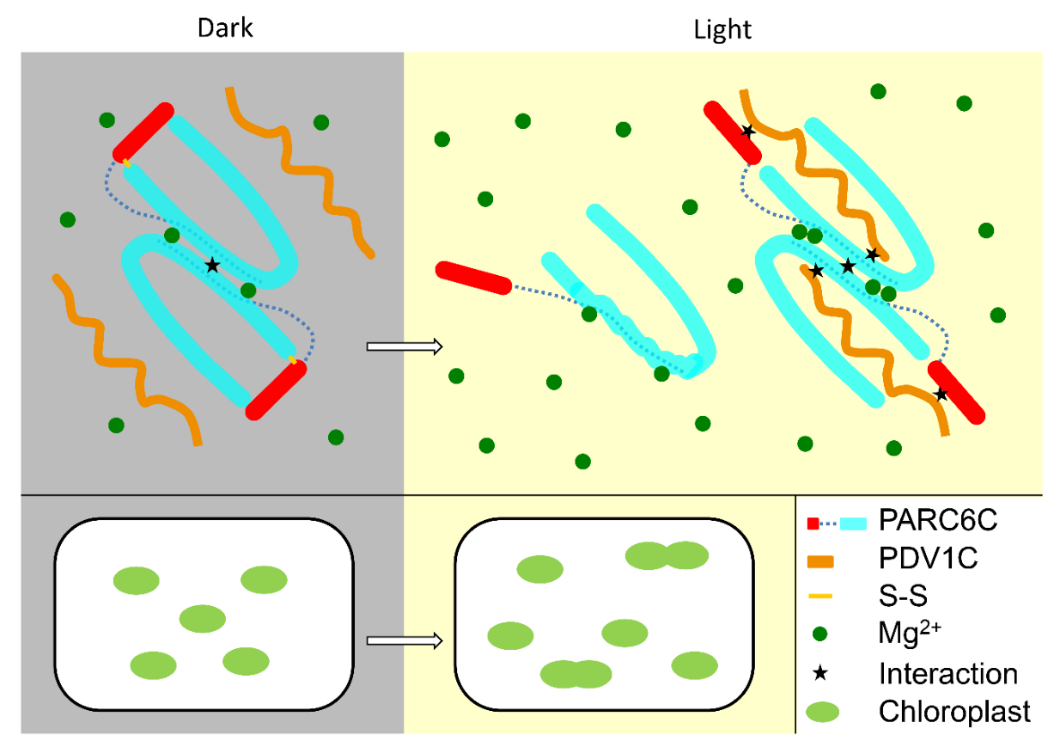
图1 parc6–pdv1复合物调控机制
综上,该研究揭示了parc6-pdv1复合物在膜间隙以及叶绿体分裂中的多层调控,扩展了对叶绿体分裂装置中min系统调控机制的理解。北京化工大学博士生曹雪利、已毕业硕士生刘子赫,以及北京林业大学孙青青博士、安传敬博士为本论文的共同第一作者,北京化工大学冯越教授与北京林业大学高宏波教授为本文的共同通讯作者。
1.k. w. osteryoung, j. nunnari, the division of endosymbiotic organelles. science 302, 1698-1704 (2003).
2.w. h. wang et al., structural insights into the coordination of plastid division by the arc6-pdv2 complex. nat plants 3, (2017).
