基于环状寡核苷酸的抗噬菌体信号系统(cyclic-oligonucleotide-based antiphage signaling system),简称cbass,是细菌的重要免疫系统。噬菌体感染细菌后将遭遇细菌免疫系统的抵抗,但噬菌体同时也采用多种策略对抗细菌的免疫系统,目前研究最清楚的是噬菌体可编码多种蛋白质以抑制宿主免疫系统如crispr-cas以及限制性修饰系统,但目前尚不清楚噬菌体是否有抑制或逃避cbass免疫系统的机制。
2023年2月6日,我校冯越课题组与美国加州大学旧金山分校joseph bondy-denomy课题组合作在cell在线发表了题为bacteriophages inhibit and evade cgas-like immune function in bacteria的研究论文,报道了噬菌体抑制和逃逸细菌cbass免疫系统的机制。

本文通过生物信息学分析,共计筛选出252株不同的含有cbass系统的p. aeruginosa菌株,使用crispr-cas技术将其cbass基因座敲除,最终筛选出一种具有天然功能性的cbass免疫系统的菌株p. aeruginosa bwhpsa011 (pa011)。该菌株含有cgas样酶cdna,其可产生3’, 3’-cgamp用以响应pamx41噬菌体感染,从而激活磷脂酶(capv)效应蛋白,发挥cbass系统的免疫功能。而pamx41噬菌体的逃逸突变体可产生一种抗cbass系统的蛋白acb2,那么acb2如何发挥其抗性功能呢?冯越教授课题组结合生物化学、结构生物学等多种手段,阐明了acb2抑制cbass系统的功能机制。首先,他们发现acb2可高效结合3’, 3’-cgamp分子,但不具有酶活。冯越课题组解析了acb2蛋白及其结合3’, 3’-cgamp的复合物的结构,结构显示acb2蛋白自身为一个紧凑的六聚体结构,其可结合3个3’, 3’-cgamp分子,每个3’, 3’-cgamp分子位于两个acb2单体n端形成的“结合口袋”中,形成稳定的相互作用。通过吸附并隔离3’, 3’-cgamp,acb2有效地破坏了cbass系统的免疫作用(图1)。后续通过体外生化实验,他们又进一步证实了acb2还可以结合c-di-amp/3’, 3’-c-di-ump/2’, 3’-cgamp/3’, 3’-cua/ug等多种寡核苷酸信号分子,覆盖i型和ii型两种cbass系统,显示出acb2是一种基于cgas酶的免疫系统的广谱抑制蛋白。此外他们还发现,acb2的缺失会造成cbass系统阻断噬菌体的复制及溶原诱导,但少数噬菌体会通过主要的衣壳基因的突变来逃避cbass系统的免疫作用(图1)。
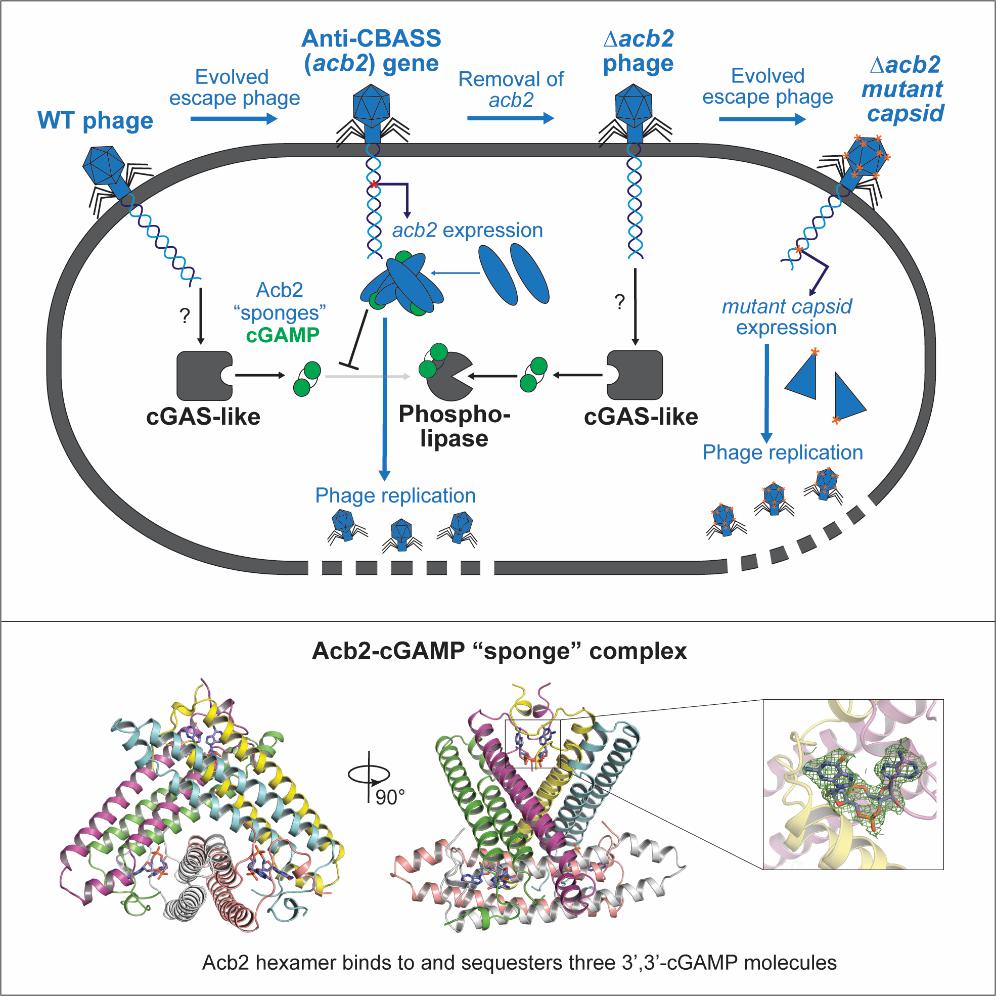
图1 acb2蛋白抗cbass系统的作用机制
综上,本文发现了内源性cbass系统的抗噬菌体免疫作用,并提出了噬菌体抑制和逃避cbass系统免疫的有效策略。acb2蛋白作为广谱抑制蛋白,其可以通过结合多种环状寡核苷酸来抑制多种类型的cbass系统。美国加州大学旧金山分校博士研究生erin huiting与我校博士研究生曹雪利为本论文的共同第一作者,我校冯越教授与加州大学旧金山分校joseph bondy-denomy教授为本文的共同通讯作者。
原文链接:https://www.sciencedirect.com/science/article/pii/s0092867422015847
通讯作者简介:冯越,北京化工大学生命学院教授,博士生导师,国家优秀青年基金获得者(2018)。主要以生物化学与分子生物学、结构生物学、细胞生物学等为手段,对微生物与宿主免疫系统相互作用等领域相关蛋白质的结构与功能开展研究。共发表sci论文44篇,其中通讯作者(含共同)论文22篇,分别发表在nature、cell、mol. cell、nat. chem. biol.、pnas、nat. plants、nat. commun.、nucleic acids res.、j. biol. chem.等国际著名期刊。作为负责人主持国家及省部级项目多项。曾获得全国青年岗位能手(2020)、北京市优秀青年人才(2020)、北京市科学技术进步奖二等奖(2018)、中国十大新锐科技人物(2018)、北京市科技新星(2019)等荣誉。
