近日,北京化工大学生命科学与技术学院刘惠玉教授团队和首都医科大学宣武医院放射科杨旗教授团队合作研究了一种基于靶向血栓部位gpiib/iiia受体的rgd肽偶联金属有机骨架(mof)衍生的含有类卟啉结构的介孔碳球(pmcs),进行特定位点光热光动力双重血栓治疗,实现了87.9%的下肢血栓再通率。相关成果发表于《advanced science》(doi: 10.1002/advs.201901378)。论文第一作者为张凤荣同学和刘玥宏同学,通讯作者为刘惠玉教授与杨旗教授。
血栓相关疾病,如缺血性卒中,急性心肌梗死、深静脉血栓形成等,具有高致死率和致残率。目前以纤维蛋白溶解药物为代表的溶栓药广泛应用于临床,但该类药溶栓后致命的出血风险是其临床应用的一大局限。因此寻求更精准、更安全、更有效的溶栓策略对于降低溶栓出血风险,改善溶栓治疗预后具有重要意义。
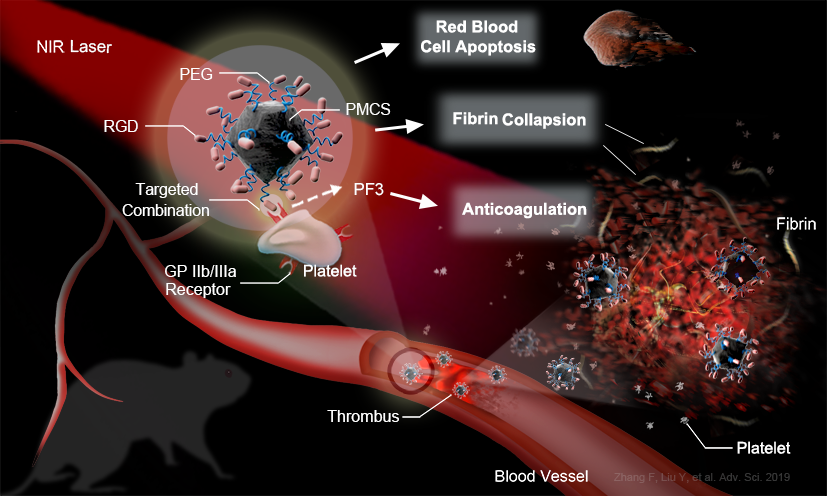
图1. 特定位点双光疗的设计思路
最近,近红外(nir)光介导的光热治疗受到了相当多的关注。研究表明,部分纳米材料能在近红外光(nir)照射下通过朗道阻尼效应将光能转化为热能并对材料邻近分子蛋白结构产生破坏。本研究使用靶向纳米颗粒介导的双模态近红外光溶栓,着重于提高生物安全性以及溶栓效应。静脉注射后,偶联rgd肽的pmcs可以主动靶向血栓,并借助nir光在血栓位点进行能量转化,使纤维蛋白骨架结构及红细胞等重要血栓组成成分崩解,从而实现有效溶栓。与传统的溶栓策略相比,该技术具有如下优势:
1. rgd-pmcs可以主动靶向活化的血小板表面上的gpiib/iiia受体,避免系统性纤维蛋白溶解疗法的高出血风险;
2. rgd-pmcs产生的活性氧可通过脂质过氧化损伤血小板第三因子,从而抑制血栓复发;
3. 光动力学和光热疗法的结合可以大大提高血栓破裂的效率并防止较大碎片的继发性栓塞。
本研究在下肢血栓模型中在一次光疗后,使用7.0 t高场磁共振在体成像证实再通率达到87.9%。综合研究结果表明,该策略是一种无创、有效的溶栓方案。该研究得到了国家重点研发计划、国家自然科学基金委以及中央高校基本科研业务费等专项经费的支持。
刘惠玉教授,北京化工大学博士生导师,国家优秀青年科学基金获得者。2007年获得中国科学院理化技术研究所博士学位,毕业后留所工作。2015年被聘为北京化工大学生命学院教授,加入“软物质科学与工程高精尖创新中心”与“有机无机复合材料国家重点实验室”。长期从事纳米生物材料的合成,在光控肿瘤治疗方向取得了重要进展。先后主持5项国家自然科学基金。在angew. chem. int. ed.,adv. mater.,acs nano 等国际期刊发表论文70余篇,引用4100余次,当期1%esi高被引论文7篇,h因子30。兼任sci期刊journal of nanoscience and nanotechnology专刊客座编辑,生物化工青年工作委员会委员,中国生物医学工程学会青年委员会委员,北京粉体技术协会第二届理事会理事,北京生物医学工程学会组织工程专业委员会委员,纳米毒理委员会青年委员,中国医药生物技术协会纳米生物技术分会常务委员。曾获中国科学院卢嘉锡青年人才奖,中国科学院“青年创新促进会”首届优秀会员,北京市科技新星等荣誉称号。
